تهیه کربنات سدیم از جوش شیرین
در روش سنتز شیمیایی از سنگ آهک و نمک معمولی
به عنوان مواد اولیه استفاده میشود. ابتدا نمک در آب حل میشود
تا محلول نمک به دست بیاید. سپس این محلول به وسیله ی گاز آمونیاک اشباع میگردد.
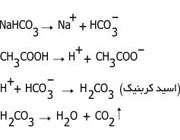
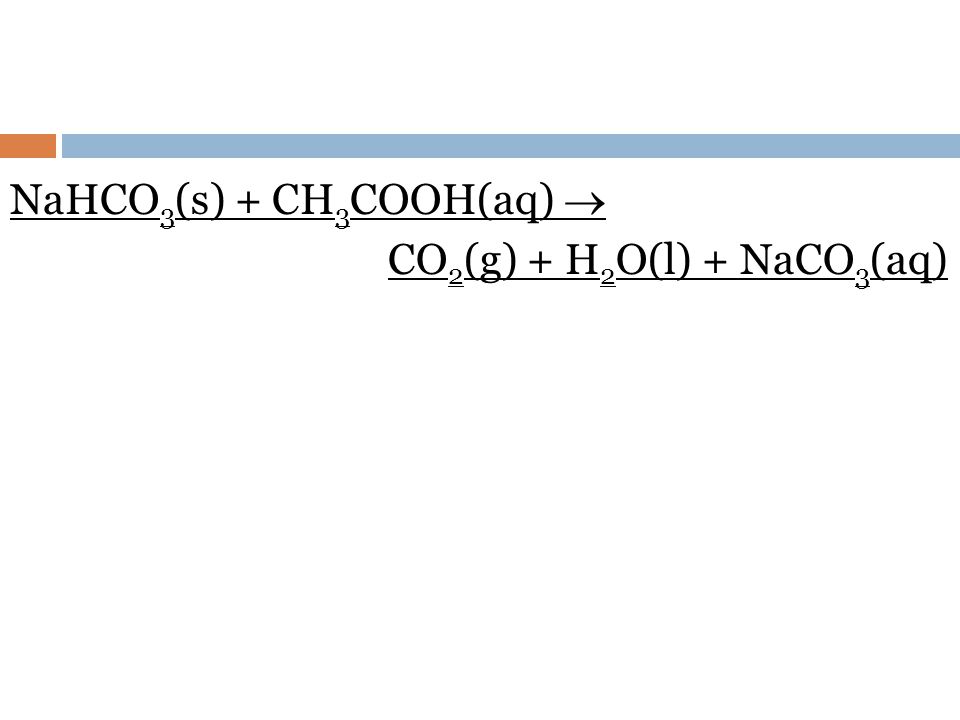
گاز دی اکسیدکربن تولید شده از حرارت سنگ آهک به داخل محلول تهیه شده دمیده میشود
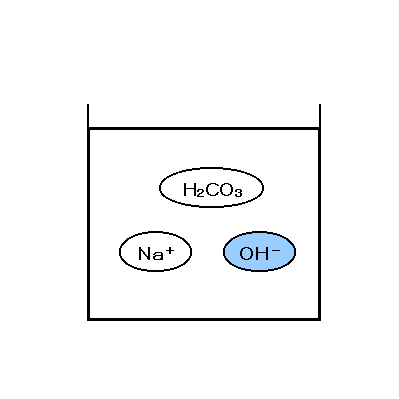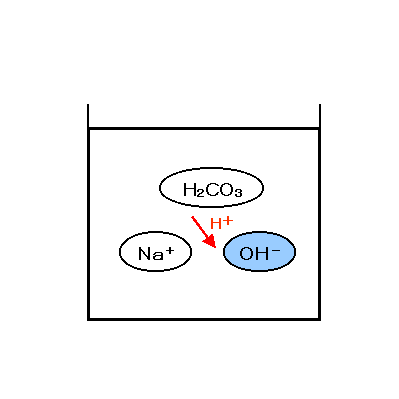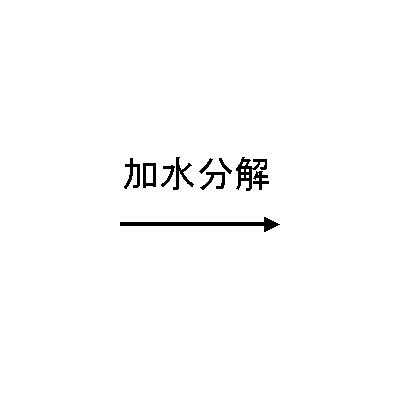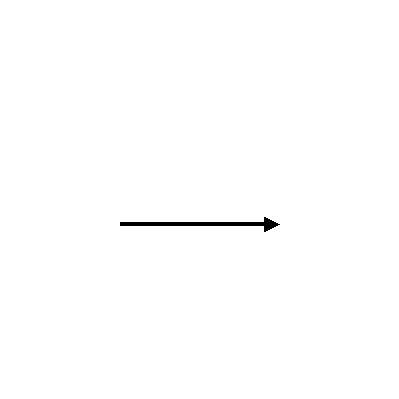
و منجر به تولید بی کربنات سدیم میشود. سپس بی کربنات سدیم را حرارت میدهند
تا تجزیه شده و کربنات سدیم تولید شود.
شرکت سولوِی دارنده دانش فنی این فرایند در سال 1963 توسط
ارنست سولوِی در بلژیک تاسیس شد.
فرآیند سولوِی
با استفاده از نمک NaCl و سنگ آهک3 CaCO بعنوان
مواد اولیه و با حضور آمونیاک
بعنوان کاتالیست در مراحل مختلف صورت گرفته
و منتج به تولید کربنات سدیم میشود.
مراحل مختلف شامل فرآیند تولید
بی کربنات سدیم، تولید کربنات سدیم و بازیافت آمونیاک میباشد.
- مرحله اول تولید بی کربنات سدیم
انجام واکنش بوسیله عبور محلول غلیظ آب نمک از
درون دو برج متوالی میباشد
که در برج اول حبابهای آمونیاک از پائین برج بالا آمده
و توسط محلول آب نمک جذب و حل میشود.
در برج دوم با تزریق گاز دی اکسید کربن، حبابهای این گاز
از محلول آب نمک آمونیاکی عبور کرده
و بی کربنات سدیم حاصل میشود.
دی اکسید کربن مورد نیاز این مرحله توسط
تجزیه حرارتی سنگ آهک بدست می آید.
در فرآیند حرارت دادن سنگ آهک، علاوه بر
گاز دی اکسید کربن، اکسید کلسیم نیز بدست می آید
که این ماده در بخش بازیافت آمونیاک مصرف خواهد شد.
محلول حاصل از این فرآیند شامل بی کربنات سدیم
و محلول کلرید آمونیوم میباشد که
با عبور از فیلتر، بی کربنات سدیم جداشده
و به مرحله دوم و تولید کربنات سدیم منتقل می شود.
- مرحله دوم تولید کربنات سدیم
بی کربنات سدیم حاصل از فرآیند اول،
به روش تجزیه حراتی (کلسیناسیون) در دمای حدود 200 درجه
سانتیگراد، با از دست دادن دی اکسید کربن و آب،
به کربنات سدیم تبدیل میشود.
دی اکسید کربن
بدست آمده در این فرآیند جهت استفاده مجدد،
به مرحله اول برگشت داده میشود.
- مرحله سوم بازیافت آمونیاک
در بخش جانبی این فرآیند، کلرید آمونیوم با اکسید کلسیم حاصل از
فرآیند تجزیه حرارتی سنگ آهک، واکنش داده و آمونیاک احیا شده
و به مرحله اول واکنش بازگشت می نماید.
همچنین محصول دیگر این فرآیند کلرید کلسیم میباشد
که بعنوان محصول جانبی قابل فروش می باشد.
در فرآیند تولید کربنات سدیم، آمونیاک به مقدار کمی
تنها بابت میزان اتلافات به واکنش اضافه شده
و مواد اولیه اصلی، سنگ آهک، نمک کلرید سدیم
و انرژی میباشد. محصولات بدست آمده
علاوه بر کربنات سدیم، کلرید کلسیم نیز می باشد.
روش دیگر تولید کربنات سدیم، فرآیند حاصل از
ترکیبات معدنی مانند ترونا و نفلین میباشد
که این روش در کشورهایی مانند آمریکا و ترکیه
که دارای ذخایر بزرگ ترونا هستند به کار میرود.
جوش شیرین (بیکربنات سدیم ) چیست؟