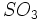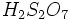مروری بر خاصیت اسید سولفوریک


نام : اسید سولفوریک
نامهای مترادف: جوهر گوگرد، سولفات هیدروژن
خلوص: 98%
فرمول شیمیایی: H2SO4
ظاهر: مایع بی رنگ
نقطه ذوب: 10 درجه سانتی گراد
نقطه جوش: 335 درجه سانتی گراد
اسید معدنی و بسیار قوی است که به طور طبیعی
در گازهای خارج شده از آتشفشان وجود دارد
و با هر درصدی در آب حل میشود.
واکنش آن با آب به شدت گرمازا است به همین دلیل باید از
اضافه کردن یک باره آب به آن اجتناب کرد.
اسید سولفوریک میل ترکیبی زیادی با آب دارد
به طوری که در واکنش با سایر مواد
هیدروژن و اکسیژن آنها را با صورت آب جدا میکند.
اسید سولفوریک خورنده است
و قسمت عمده ای از باران اسیدی را تشکیل میدهد.
قطرات آب به هنگام بارش با آلاینده های کارخانه ها
و خودرو ها که در هوا معلق هستند واکنش میدهند و تولید اسید میکنند.
اسید سولفوریک با فلزات واکنش میدهد
و هر چه دما بالاتر رود میزان این واکنش بیشتر خواهد شد
اما بر روی جیوه و سرب تاثیری ندارد.
اسید سولفوریک از انحلال گاز SO3 در آب بدست می آید،
البته روش های صنعتی زیادی برای تولید این اسید پر کار برد وجود دارد.
روش رایج تهیه آزمایشگاهی اسید هایی مانند نیتریک اسید(HNO3)
و اسید کلریدریک (HCl)، اینگونه است که ابتدا مقداری
اسید سولفوریکرا در ظرف تقطیر ریخته،
نمک با یون مورد نظر (یون کلرید،نیترات و...)
را به آن اضافه کرده و بعد از بستن درب ظرف،آنرا حرارت میدهند
و اسید مورد نظر را از آن طرف ظرف، جمع آوری میکنند.
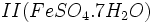 که زاج سبز نامیده میشود
که زاج سبز نامیده میشود 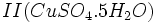 که
که حاصل شده ،
حاصل شده ، ایجاد میکند.
ایجاد میکند. به آرامی از میان آب ،
به آرامی از میان آب ، گازی به اسید سولفوریک اضافه میشود،
گازی به اسید سولفوریک اضافه میشود،مواد ناسازگار با آن شامل:
- کاربرد های مهم
- اسید سولفوریک
 اسید سولفوریک
اسید سولفوریک
جزء مواد شیمیایی پراستفاده میباشد.
این ماده در واکنشهای شیمیایی
و فرآیندهای تولید سایر ترکیبات ، کابرد فراوانی دارد.
عمدهترین استفاده آن در
کارخانههای تولید کود شیمیایی ، استخراج فلزات ،
سنتزهای شیمیایی ، تصفیه پسابها و پالایشگاههای نفت میباشد.
اسید سولفوریک در اثر واکنش با اسید نیتریک ، یون نیترونیوم تولید میکند
که در فرآیند نیترودار کردن ترکیبات استفاده میشود.
، نیترو گلیسیرین و ... استفاده میشود.
در صنایع تولید مواد منفجره مانند تولید ترینیتروتولوئن (TNT)
فرآیند نیترودار کردن

(باطریهای سربی)
به عنوان محلول الکترولیت استفاده میشود

، یک عامل آبگیری بسیار قوی است.
در اکثر واکنشها به عنوان عامل هیدراتاسیون استفاده میشود
و در تولید میوههای خشک هم به میزان کم ،
از اسید سولفوریک برای جذب آب استفاده میکنند.
واکنش باور نکردنی اسید سولفوریک با شکر
این واکنش دهیدراته کردن(آبگیری) شکر
توسط سولفوریک اسید است.
در واکنش محلول غلیظ اسید سولفوریک با قند یا شکر ،
مولکولهای سازنده ی دانه های شکر که از جنس ساکاروز هستند،
توسط اسید سولفوریک آبگیری میشوند.
آزمایش بسیار ساده است .
کافی است کمی شکر را در یک بشر بریزید
وسپس به آن اندکی سولفوریک اسید غلیظ بیفزایید
البته میتوانید کمی آب نیز به شکر بیفزایید
یا به عبارتی از محلول خیلی غلیظ آن استفاده کنید.
سولفوریک اسید در مدت زمان بسیار کوتاهی
طی یک واکنش به شدت گرما زا شکر را دهیدراته میکند.
که نتیجهی آن گرما ،بخار آب وبخاری از اکسیدهای گوگرد است.
جدا از بوی گوگرد بوهایی شبیه به کارامل نیز استشمام میکنید.
نهایتا شکر سفید به شکل استوانه ی سیاه رنگ
از کربن به خارج از بشر فوران می کند.
میدانید که شکر یک کربوهیدارت است که
وقتی آب ازمولکول آن حذف شود فقط کربن میماند .
این واکنش از دسته واکنشهای حذفی است
شما میتوانید به جای شکر از قند استفاده کنید
با اضافه نمودن اسید سولفوریک به حبه های قند با گذشت زمان اندکی،
بین قند و اسید سولفوریک واکنش رخ داده
و حبه های قند مثل دانه های شکر ضمن افزایش حجم
به رنگ سیاه ، تغییر رنگ میدهند.
آنچه محصول واکنش است و در پایان واکنش باقی میماند،
کربن، بخار آب، کربن دی اکسید و دی اکسید گوگرد است.
ماده سیاه رنگ ایجاد شده همان کربن میباشد.
این واکنش هم مانند واکنش شکر با اسید سولفوریک گرماده بوده
و آب موجود در محصول به صورت بخار از کربن ایجاد شده خارج میشود.
البته باید توجه نمود گاز ایجاد شده، بخار آب خالص نیست
و ممکن است ذرات ریز اسید سولفوریک نیز در این بخار وجود داشته باشد.
هنگام آزمایش ،نکان ایمنی را حتما رعایت کنید
هنگام کار با سولفوریک اسید غلیظ دستکش وعینک ایمنی را فراموش نکنید.
ومسلما اگه آزمایش زیر هود انجام شود خیلی بهتر خواهد بود.
واکنش آبگیری | دهیدارته کردن شکر:
حاصل واکنش جوش شیرین و سرکه
جوش شیرین (بی کربنات سدیم) باز است
درحالی که سرکه، اسید است.
وقتی شما آنها را مخلوط می کنید با هم واکنش میدهند،
بعد از واکنش اسید کربنیک به وجود می آید که
خیلی ناپایدار و بی ثبات است
و فوراً به آب و دی اکسید کربن شکسته میشود
و آتشفشان زیبایی را برایتان به وجود می آورد.
دو نوع واکنش که بر اساس تغییرات گرما وجود دارد،
به نامهای واکنش های گرماده و گرماگیر.
آن دسته از واکنشهایی که
در آنها گرما تولید میشود را واکنشهای گرماده میگویند.
آن دسته از واکنشهایی که برای انجام آن ها گرما جذب میشود،
به عنوان واکنشهای گرماگیر تعریف میشوند.
بنابراین ترکیب سرکه و جوش شیرین که
ترکیب باز و اسید است یک واکنش گرماده است.