واکنش سدیم با کلر
واکنش سدیم با آب
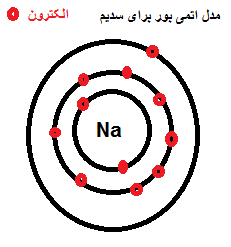
سدیم
Natrium Na-
خواص فیزیکی وشیمیایی
عدد اتمی:11
وزن اتمی:
22.989770 amu
شعاع اتمی (calc.):
2.23 Å
شعاع کووالانسی:
1.54 Å
نقطه ذوب:
97.72 °C (370.87 K, 207.9 °F)
نقطه جوش:
883 °C (1156 K, 1621 °F)
رنگ:
سفید نقرهی چگالی در دمای293 K:
0.971 g/cm3
سدیم مانند دیگر فلزات قلیا یی ،
نرم ، سبک وزن ، سفید میل به نقرهی و واکنش دهنده است
و از ین جهت هرگز بهصورت آزاد در طبیعت یافت نمیشود.
این عنصر بسیار واکنش دهنده است و با شعله زرد رنگی میسوزد
در آزمایشهای مربوط به هوا اکسید میشود
و به شدت با آب واکنش میدهد
از این رو باید همیشه در زیر نفت یا روغن نگهداری شود.
کاربردها مهم آن عبارتند از:
سدیم، در حالت فلزی عنصر لازم برای ساختن استرها و ترکیبات آلی است.
این عنصر قلیایی بهوجود آورنده عنصر حیاتی نمک طعام (کلیرید سدیم) نیز هست.
کاربردهای دیگر عبارتند از:
سدیم، در حالت فلزی عنصر لازم برای
ساختن استرها و ترکیبات آلی است.
این عنصر قلیایی بهوجود آورنده
استفاده در برخی از آلیاژها
برای بهبودی ساختارشان استفاده در ساخت صابون
سدیم در آب وطهور شده ،
آن را تجزیه کرده ، هیدروژن آزاد میکند
و هیدروکسید میسازد.
سدیم در آب فورا آتش میگیرد،
ولی در هوی معمولی در دمای زیر 388 کلوین آتش نمیگیرد.
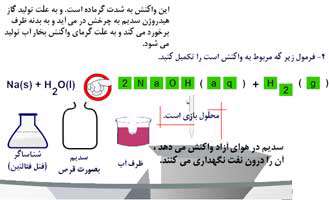
واکنش سدیم با آب
عنصر سدیم طبق مکانیسم زیر واکنشی قوی با آب می دهد:

2 Na (s) + 2 H2O (aq) ---> 2 NaOH (aq) + H2 (g)
حاصل این واکنش بالا
محلولی بی رنگ محتوی باز قوی سدیم هیدروکسید و گاز هیدروژن است.
این یک واکنش گرماده است
و طی آن فلز سدیم داغ شده با شعله ی اختصاصی نارنجی رنگی میسوزد.
در روند سوختن سدیم گاز هیدروژن آزاد میشود که
واکنشی قوی با اکسیژن موجود در هوا میدهد.
برخی از ترکیبات سدیم هستند که نمیتوانند با چنین
قدرتی با آب واکنش دهند ولی به همین نسبت در آب حل میشوند.
بنابراین اگر سدیم در تماس با آب قرار بگیرد
در طی یک واکنش سدیم هیدروکسید و هیدروژن تولید میکند.
پتاسیم در این مورد از سدیم بسیار شدیدتر با آب واکنش میدهد.
این واکنشها حرارت زیادی تولید میکنند.
بنابراین تصور اینکه انفجاری که رخ میدهد
به دلیل احتراق هیدروژن است منطقی به نظر میرسد.
اما برای اینکه یک واکنش به انفجار ختم شود،
واکنشدهندهها باید به سرعت و به خوبی با هم مخلوط شوند.
با این حال درمورد فلزهای قلیایی،
گاز هیدروژن و بخاری که درنتیجهی واکنش در سطح فلز آزاد میشود
از رسیدن آب به آن جلوگیری میکند؛
و بدون تأمین مستمر آب واکنش ادامه پیدا نخواهد کرد.