مروری بر انواع واکنش های شیمیایی با مثال-5
واکنش جانشینی دوگانه یا واکنش دو جایگزینی
واکنشهایی که در حال محلول صورت میگیرند،
به چند دلیل معمولا سریعاند.
مواد واکنش دهنده ، وقتی به صورت محلول درمیآیند،
دیگر انبوههای از یون یا مولکول
(آنگونه که در حالت خالص دیده میشوند) نیستند.
درفرایند انحلال ،
نیروهای جاذبه بین ذرات (یونها یا مولکولهای) مواد حل شونده ،
تا اندازهای تحت الشعاع نیروی جاذبه
بین مجموعه مولکولهای حلال و ذرات منفرد قرار گرفتهاند
و ذرات مزبور میتوانند آزادانه در محلول حرکت کنند.
واکنش خنثی شدن اسیدها با بازها نیز
از نوع جا به جایی دوگانه میباشد.
زمانیکه یک اسید و یک باز با هم واکنش میدهند
آب و نمک تولید میشود.
میتوان تصور کرد که
فلز موجود در باز جای خود را با هیدروژن موجود در اسید تعویض میکند.
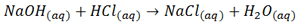
در ضمن واکنشهایی که در آنها یک عنصر آزاد وجود دارد
نمیتواند از نوع جا به جایی دو گانه باشد،
زیرا در این واکنش ها باید دو ترکیب داشته باشیم.


























