مروری بر ساختار نمک طعام و نحوه حل شدن آن در آب
نمک خوراکی از
سدیم وکلر ساخته شدهاست.
در آب محلول است و از مهمترین املاحی است که
در خوراک روزانه مورد انسانها به کار میرود.
تهیه نمک خوراکی با بهرهگیری از دو منبع امکانپذیر است؛
 سنگ نمک
سنگ نمک  آب شور یا آب نمک.
آب شور یا آب نمک. نمک خوراکی
به شکل معدنی در تهنشینها
و رسوبها همچین چین خوردگیها وجود دارد
که به شکل سنگ نمک استخراج میشود.
همچنین در آب دریاها به مقدار
فراوان موجود است که قابل برداشت نیز میباشد
نمک خوراکی مانند دیگر نمکها ترکیب یونی است.
با ورود ناخالصی به بلور هالیت یا نمک خوراکی،
این کانی به رنگهای گوناگون در میآید
برای نمونه
در محیطهای تبخیری و گرم و خشک یافت میشود.
مزه شور و جلای شیشهای و سختی کم این کانی باعث شدهاست
تا به آسانی میان گروهی از کانیهای مشابه خود، شناخته شود.
بنابراین میتوان گفت که
سدیم کلرید، یک ترکیب یونی است که از
واکنش بین سدیم مذاب و گاز کلر بهدست میآید.
این واکنش همراه با تولید گرما و نور انجام میگیرد.
در طی این واکنش
یک الکترون از اتمهای سدیم به اتمهای کلر منتقل میشود
و هر دو به آرایش هشتتایی میرسند.
در این فرایند
سدیم به کاتیون سدیم و کلر به آنیون کلرید تبدیل میشود.
هنگام حل کردن نمک در آب،
یونهای مثبت و منفی آن به صورت زیر از هم جدا میشوند:
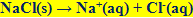
بنابراین حل شدن نمک در آب، مثالی از تغییر شیمیایی است.
مولکولهای قطبی آب ، از سر مخالف
اطراف یونهای مثبت و منفی سدیم کلرید را گرفته
و انها را از یکدیگر جدا میکنند .
قسمتهای منفی مولکولهای آب
به سمت یونهای مثبت (Na+) جذب شده
و قسمتهای مثبت آب به سمت یون های منفی(Cl-) جذب میشوند.
بنابراین نیروی جاذبه بین
بارهای مخالف، یونهایNa+ و Cl- نمک را از هم جدا میکند.
هنگامیکه مولکولهای آب اطراف هر یون قرار میگیرند،
لایه هیدرات (آب دار) اطراف هر یون نمک تشکیل می شود.
این خاصیت جدید باعث میشود
یونهای Na+ و Cl- دوباره نتوانند با هم
ترکیب یونی قبل از انحلال را تشکیل دهند.
بنابراین در این حالت است که گفته میشود
" نمک، حل شده است".
مراحل انحلال NaCl در آب
همه در کتابهای درسی خوانده ایم
و میدانیم که علت حل شدن مواد عبارتند از :
رسیدن به سطح انرژی پایین تر
و همچنین رسیدن به بی نظمی بیشتر
البته مهمترین عوامل موثر در انحلال مواد عبارتند از :
گرمای انحلال و بی نظمی
مراحل حل شدن جامدات یونی عبارتند از :
جداشدن یونها (گرماگیر) ،
آب پوشی یونها (گرمازا)
جامدات یونی ، یون ها قبلآ در ترکیب خالص وجود دارند.
وقتی چنین ترکیبی در آب حل میشود یونها تفکیک میشوند.
مانند سدیم کلرید NaCl ،
برخی دیگر از مواد در هر فاز که باشند شامل یون نیستند
ولی در آب یون تولید میکنند
در ابتدا که نمک را در آب ریختیم،
فرآیند حل شدن که شامل یونیزه شدن NaCl
به کاتیونهای سدیم و آنیونهای کلر است،
اغلب در یک جهت معینی از بلور به سوی محلول انجام میگیرد.
با پیشرفت فرآیند حل شدن و افزایش غلظت یونها درمحلول،
واکنش معکوس نیز امکان پذیر میشود.
یعنی افزوده شدن یونهای محلول به
بلور تبلوریا رسوب کردن انجام میشود.
مادام که موازنه این دو فرایند برقرار است،
مقدار نمک حل شده در واحد حجم محلول ثابت خواهد بود
و سیستم در تعادل انحلال پذیری باقی خواهد ماند.
حالت فیزیکی و سرعت واکنش
سرعت واکنش ،
عبارت از
تغییر غلظت هر یک از مواد اولیه یا مواد حاصل نسبت به زمان انجام واکنش است.
برای انجام یک واکنش،
واکنش دهنده ها باید در مجاورت یکدیگر قرار بگیرند و با هم مخلوط شوند.
بنابراین اگر واکنش دهنده ها در یک فاز باشند،
مثلا همگی گاز یا محلول در آب باشند،
واکنش با سرعت بیشتری رخ خواهد داد.
زیرا در این حالت واکنش دهنده ها بهتر با هم مخلوط شده
و در نتیجه احتمال برخورد بین آنها زیاد میشود
و سرعت واکنش هم افزایش می یابد.
اما اگر واکنش دهنده ها در دو فاز مختلف باشند
مثلا مجاورت یک گاز با یک ماده جامد یا دو مایع مخلوط نشدنی،
در این حالت مجاورت واکنش دهنده ها
تنها به مرز میان دو فاز بستگی دارد.
وقتی چند ماده واکنش دهنده به صورت جامد باشند،
برای افزایش سرعت واکنش میتوان آنها را خرد یا پودر کرد.
زیرا در این حالت سطح تماس بین مواد واکنش دهنده بیشتر شده
و سرعت نیز بیشتر میشود.
راه دیگر برای افزایش سرعت
واکنش بین دو ماده جامد استفاده از یک حلال مناسب است.
مانند واکنش زیر ضمن ساییدن دو جامد،
مقداری از رطوبت موجود در هوا جذب بلورها شده
و در مقیاس میکروسکوپی در سطح بلورهای KI و
Pb(NO3)2 فاز محلول (aq) ایجاد میشود
و واکنش بین آن ها انجام میگیرد.
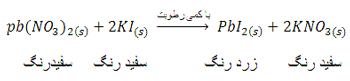
بنابراین برای انجام یک واکنش ،
ابتدا واکنشدهندهها باید با هم مخلوط شوند
تا در مجاورت همدیگر قرار گیرند.
اگر واکنشدهندهها همفاز باشند،
یعنی همگی گاز یا بصورت حل شده در حلالی باشند،
واکنش با سرعت بیشتری رخ میدهد.
دربعضی از واکنشها،
افزایش غلظت واکنش دهنده ها روی سرعت واکنش اثر فزاینده دارد
برای مثال الیاف آهن در هوای معمولی روی شعله،
داغ و سرخ میشوند ولی نمیسوزند.
اما الیاف آهن که قبلا داغ و سرخ شده اند
در اکسیژن خالص به شدت می سوزند.
تفاوت چشم گیر مشاهده شده در
سرعت این واکنش را میتوان با
افزایش غلظت اکسیژن در واکنش توجیه کرد.
بنابراین غلظت بیشتر واکنشدهندهها
باعث ایجاد برخورد بیشتر بین آنها میشود
و هر چه تعداد برخوردها بیشتر باشد،
تعداد برخوردهای موثر هم بالا میرود
بنابراین سرعت واکنش هم بیشتر میشود.
همچنین افزایش دما باعث افزایش برخورد موثر بین واکنش دهنده ها
و در نتیجه افزایش سرعت در کلیه واکنشهای گرماگیر و گرماده میشود.
مثلا واکنش فلز منیزیم صیقل داده شده با آب سرد بسیار کند
و با آب جوش نسبتا سریعتر است.
در نتیجه از مهمترین عوامل مؤثر بر سرعت واکنشهای شیمیایی است.
در برخی از واکنشها با افزایش چند درجه سانتیگراد ،
سرعت واکنش ممکن است چند برابر بیشتر شود.
البته استثناهایی هم وجود دارد.
بنابراین عوامل موثر بر سرعت واکنش های شیمیایی عبارتند از :
 ماهیت واکنش دهنده ها
ماهیت واکنش دهنده ها حالت فیزیکی
حالت فیزیکی غلظت
غلظت دما
دما کاتالیزگر
کاتالیزگرکاتالیزورها سرعت یک واکنش شیمیایی را که از
لحاظ ترمودینامیکی قابل انجام است، تغییر میدهند.
بنابراین نمیتوانند واکنشهایی را که از نظر
ترمودینامیک امکانپذیر نیستند، به انجام برسانند.
کاتالیزورها با پیش بردن یک واکنش از
مسیر دیگرانرژی فعالسازی را کم کرده
و باعث افزایش سرعت واکنشها میشوند.