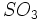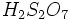مروری بر خاصیت اسید سولفوریک


نام : اسید سولفوریک
نامهای مترادف: جوهر گوگرد، سولفات هیدروژن
خلوص: 98%
فرمول شیمیایی: H2SO4
ظاهر: مایع بی رنگ
نقطه ذوب: 10 درجه سانتی گراد
نقطه جوش: 335 درجه سانتی گراد
اسید معدنی و بسیار قوی است که به طور طبیعی
در گازهای خارج شده از آتشفشان وجود دارد
و با هر درصدی در آب حل میشود.
واکنش آن با آب به شدت گرمازا است به همین دلیل باید از
اضافه کردن یک باره آب به آن اجتناب کرد.
اسید سولفوریک میل ترکیبی زیادی با آب دارد
به طوری که در واکنش با سایر مواد
هیدروژن و اکسیژن آنها را با صورت آب جدا میکند.
اسید سولفوریک خورنده است
و قسمت عمده ای از باران اسیدی را تشکیل میدهد.
قطرات آب به هنگام بارش با آلاینده های کارخانه ها
و خودرو ها که در هوا معلق هستند واکنش میدهند و تولید اسید میکنند.
اسید سولفوریک با فلزات واکنش میدهد
و هر چه دما بالاتر رود میزان این واکنش بیشتر خواهد شد
اما بر روی جیوه و سرب تاثیری ندارد.
اسید سولفوریک از انحلال گاز SO3 در آب بدست می آید،
البته روش های صنعتی زیادی برای تولید این اسید پر کار برد وجود دارد.
روش رایج تهیه آزمایشگاهی اسید هایی مانند نیتریک اسید(HNO3)
و اسید کلریدریک (HCl)، اینگونه است که ابتدا مقداری
اسید سولفوریکرا در ظرف تقطیر ریخته،
نمک با یون مورد نظر (یون کلرید،نیترات و...)
را به آن اضافه کرده و بعد از بستن درب ظرف،آنرا حرارت میدهند
و اسید مورد نظر را از آن طرف ظرف، جمع آوری میکنند.
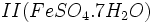 که زاج سبز نامیده میشود
که زاج سبز نامیده میشود 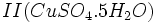 که
که حاصل شده ،
حاصل شده ، ایجاد میکند.
ایجاد میکند. به آرامی از میان آب ،
به آرامی از میان آب ، گازی به اسید سولفوریک اضافه میشود،
گازی به اسید سولفوریک اضافه میشود،مواد ناسازگار با آن شامل:
- کاربرد های مهم
- اسید سولفوریک
 اسید سولفوریک
اسید سولفوریک
جزء مواد شیمیایی پراستفاده میباشد.
این ماده در واکنشهای شیمیایی
و فرآیندهای تولید سایر ترکیبات ، کابرد فراوانی دارد.
عمدهترین استفاده آن در
کارخانههای تولید کود شیمیایی ، استخراج فلزات ،
سنتزهای شیمیایی ، تصفیه پسابها و پالایشگاههای نفت میباشد.
اسید سولفوریک در اثر واکنش با اسید نیتریک ، یون نیترونیوم تولید میکند
که در فرآیند نیترودار کردن ترکیبات استفاده میشود.
، نیترو گلیسیرین و ... استفاده میشود.
در صنایع تولید مواد منفجره مانند تولید ترینیتروتولوئن (TNT)
فرآیند نیترودار کردن

(باطریهای سربی)
به عنوان محلول الکترولیت استفاده میشود

، یک عامل آبگیری بسیار قوی است.
در اکثر واکنشها به عنوان عامل هیدراتاسیون استفاده میشود
و در تولید میوههای خشک هم به میزان کم ،
از اسید سولفوریک برای جذب آب استفاده میکنند.